
LIPUS (Low Intensity Pulsed Ultrasound)
คือคลื่นความดันตามยาวที่มีการสั่นอย่างต่อเนื่อง โดยมีความถี่สูงเกินกว่าที่หูมนุษย์สามารถได้ยินได้ โดยทั่วไปมีความถี่มากกว่า 20 กิโลเฮิรตซ์ (kHz)
คลื่นเสียงชนิดนี้ถูกนำมาใช้ในหลายแวดวงทางการแพทย์ เช่น
คลื่นเสียงกำลังต่ำแบบพัลส์ สำหรับการวินิจฉัยภาพ (Ultrasound imaging)
คลื่นเสียงระดับกลาง ในการทำกายภาพบำบัด
คลื่นเสียงกำลังสูงแบบโฟกัส สำหรับการผ่าตัดด้วยความร้อน (High-intensity focused ultrasound: HIFU)
แม้ว่าคลื่นเสียงเพื่อการวินิจฉัยและการรักษา รวมถึงคลื่นเสียงความถี่ต่ำแบบพัลส์ (LIPUS) จะมีความเข้มคล้ายกัน แต่กลับให้ผลทางชีวภาพที่แตกต่างกันอย่างชัดเจน
LIPUS สำหรับการซ่อมแซมกระดูก
เป็นวิธีรักษาที่ไม่ต้องผ่าตัด โดยมีเป้าหมายเพื่อ ลดระยะเวลาการสมานกระดูก และ ป้องกันภาวะกระดูกไม่ติด (non-union) โดยการส่งแรงกระตุ้นเชิงกลระดับจุลภาค (micro-mechanical stress) ไปยังกระดูก เพื่อกระตุ้นกระบวนการฟื้นฟูกระดูกให้เกิดขึ้นตามธรรมชาติ
ในปี 2018 สถาบัน NICE (National Institute for Health and Clinical Excellence) ได้แนะนำว่า ข้อมูลทางวิทยาศาสตร์ที่มีในขณะนั้นเกี่ยวกับการใช้ LIPUS เพื่อช่วยสมานกระดูกที่ติดช้า (delayed union) หรือกระดูกไม่ติด (non-union) ไม่พบข้อกังวลด้านความปลอดภัยที่สำคัญ แต่ ยังขาดหลักฐานที่มีคุณภาพเพียงพอในการยืนยันประสิทธิผล ของการรักษานี้อย่างชัดเจน
กระบวนการสมานกระดูกเป็นกระบวนการชีวภาพที่ซับซ้อน
โดยทั่วไปแล้ว การรักษามาตรฐานสามารถทำให้กระดูกติดได้ในผู้ป่วยส่วนใหญ่ อย่างไรก็ตาม บางกรณีอาจเกิดภาวะ “กระดูกไม่ติด” (non-union) ซึ่งมีอาการชัดเจนและจำเป็นต้องได้รับการแทรกแซงเพิ่มเติมในภายหลัง
การรักษาภาวะกระดูกไม่ติดมักต้องอาศัยการผ่าตัด ซึ่งเกี่ยวข้องกับ ความเสี่ยงและผลข้างเคียง เช่น
การติดเชื้อ
การบาดเจ็บของเนื้อเยื่ออ่อน
อาการปวดหลังผ่าตัด
การเกิดลิ่มเลือด
ภาวะแทรกซ้อนจากการวางยาสลบ
นอกจากผลกระทบต่อสุขภาพแล้ว ภาวะกระดูกไม่ติดยังส่งผลให้ผู้ป่วยสูญเสียความสามารถในการพึ่งพาตนเอง และอาจสูญเสียรายได้ ส่งผลให้เกิดภาระทางเศรษฐกิจทั้งต่อบุคคลและต่อระบบรัฐ
ในผู้ป่วยเบาหวาน ความเสี่ยงยิ่งสูงขึ้น
มีข้อมูลระบุว่า ประมาณ 1 ใน 4 ของผู้ป่วยเบาหวาน มีภาวะเจ็บป่วยร่วมอื่น ๆ (comorbidities) ที่ส่งผลต่อการสมานกระดูกโดยตรง โดยเฉพาะอย่างยิ่ง:
ประวัติ ภาวะเส้นประสาทส่วนปลายเสื่อมจากเบาหวาน (diabetic peripheral neuropathy)
ค่า HbA1c ที่สูงกว่า 7% ซึ่งบ่งชี้ถึงการควบคุมระดับน้ำตาลในเลือดที่ไม่ดี
ทั้งสองปัจจัยนี้มีความเกี่ยวข้องกับ ความเสี่ยงที่เพิ่มขึ้นในการเกิดภาวะแทรกซ้อนระหว่างกระบวนการฟื้นฟูกระดูก
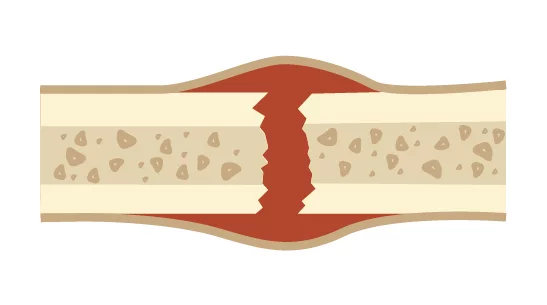
สรีรวิทยาของการสมานกระดูก
การสมานกระดูกประกอบด้วย 4 ระยะหลักตามลำดับเวลา ได้แก่
ระยะอักเสบ (Inflammation)
การสร้างคอลลัสอ่อน (Soft callus formation)
การสร้างคอลลัสแข็ง (Hard callus formation)
การปรับโครงสร้างกระดูก (Bone remodeling)
🩸 ระยะอักเสบ (Inflammatory Phase)
ระยะเริ่มต้นนี้เกิดจากการที่หลอดเลือดและเนื้อเยื่อรอบกระดูก (periosteum), หน่วยกระดูก (osteon), และท่อ perforating ถูกทำลาย ส่งผลให้เกิด ก้อนเลือดบริเวณกระดูกหัก (fracture haematoma)
การไหลเวียนของเลือดในบริเวณนั้นชะลอตัวลง ทำให้:
เกล็ดเลือดรวมตัวกัน
กระดูกบริเวณที่ได้รับบาดเจ็บเกิดเนื้อตาย
มีการปล่อยสาร cytokine อักเสบ ต่าง ๆ ออกมา
เกล็ดเลือดจะปล่อย สารกระตุ้นการเจริญเติบโต (growth factors) เช่น
Transforming Growth Factor-beta (TGF-β)
Platelet-Derived Growth Factor (PDGF)
Cytokine เหล่านี้จะกระตุ้นให้ เซลล์ต้นกำเนิด (mesenchymal stem cells) เคลื่อนที่มายังบริเวณกระดูกหัก เพื่อเพิ่มจำนวนเซลล์ชนิดพหุศักยภาพ (pluripotent cells) และเริ่ม ผลิตโปรตีนกระตุ้นการสร้างกระดูก (bone morphogenetic proteins)
ต่อมา ร่างกายจะเริ่มผลิตสาร IGF-1 (Insulin-like Growth Factor) และ VEGF (Vascular Endothelial Growth Factor) เพื่อ กระตุ้นการสร้างหลอดเลือดใหม่ (angiogenesis), การชักนำเซลล์ (chemotaxis) และ การแบ่งตัวและเปลี่ยนแปลงของเซลล์ (proliferation and differentiation) เพื่อเข้าสู่ระยะถัดไปของการสมานกระดูก
🧬 ระยะคอลลัสอ่อน – คอลลัสแข็ง และการสร้างกระดูกใหม่
ในช่วงเวลา 2–5 วันหลังการบาดเจ็บ เซลล์ที่เกี่ยวข้องกับการสร้างกระดูก เช่น osteogenic cells และ fibroblasts จะเดินทางมายังบริเวณกระดูกหัก
เซลล์เหล่านี้จะสร้าง คอลลาเจน และก่อตัวเป็นเนื้อเยื่อพังผืดนิ่ม (soft fibrocartilaginous callus) เชื่อมระหว่างปลายกระดูก
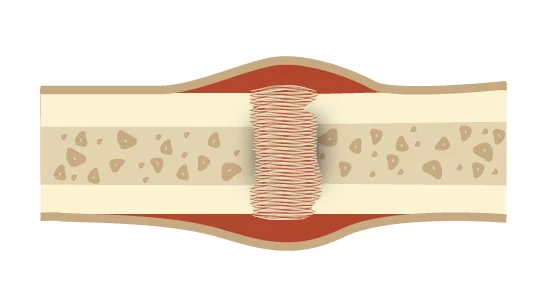
ช่วงเวลา ประมาณวันที่ 20 หลังบาดเจ็บ คอลลัสอ่อนนี้จะเริ่ม กลายเป็นหินปูน และแข็งตัว (calcify) ซึ่งเกิดจากการที่ osteogenic cells เปลี่ยนไปเป็น osteoblasts เพื่อเริ่มกระบวนการ การสร้างกระดูกแบบ intramembranous ossification และสร้าง woven bone ขึ้นมาใหม่
ในระยะสุดท้าย osteoblasts และ osteoclasts จะทำงานร่วมกันเพื่อ ปรับโครงสร้างกระดูก ให้กลับมาแข็งแรงตามสภาพปกติ

🧠 ปัจจัยที่มีผลต่อการสมานกระดูก
การสมานกระดูกได้รับอิทธิพลจากหลายปัจจัยหลัก ได้แก่:
1. ปัจจัยจากตัวผู้ป่วย (Systemic variables)
อายุ
ระดับกิจกรรม
โรคประจำตัว เช่น เบาหวาน, ภาวะโลหิตจาง
ภาวะโภชนาการ และการขาดวิตามิน (A, C, D, K)
ความผิดปกติของฮอร์โมน เช่น ฮอร์โมนเร่งการเจริญเติบโต (GH)
พฤติกรรมเสี่ยง เช่น การสูบบุหรี่ หรือดื่มแอลกอฮอล์
2. ปัจจัยที่เกี่ยวกับกระดูก (Bone variables)
ขนาดของช่องว่างระหว่างกระดูก
ตำแหน่งที่กระดูกหัก
สภาพแวดล้อมของกระดูกที่ผิดปกติ เช่น การติดเชื้อ หรือเคยได้รับรังสีรักษา
ปัจจัยจากลักษณะของบาดแผล (Injury-related variables)
ความรุนแรงของการบาดเจ็บต่อเนื้อเยื่ออ่อน, หลอดเลือด, และเส้นประสาท
การหักแบบเปิด (open fracture)
การแตกละเอียดของกระดูก (comminution)
การสูญเสียเนื้อเยื่อ
การหลุดของเยื่อหุ้มกระดูก (periosteal stripping)
⚠️ เบาหวานกับผลกระทบต่อการสมานกระดูก
โรคเบาหวาน ส่งผลกระทบต่อหลายขั้นตอนในกระบวนการสมานกระดูก และเป็นปัจจัยสำคัญที่ทำให้เกิด
การสมานที่ล่าช้า (delayed union)
ภาวะกระดูกไม่ติด (non-union)
โดยเฉพาะในผู้ป่วยที่เข้ารับ การผ่าตัดบริเวณเท้าและข้อเท้า ไม่ว่าจะเป็นการผ่าตัดตามแผนหรือตามเหตุฉุกเฉินจากอุบัติเหตุ
ประเภทของเบาหวาน
🩸 เบาหวานชนิดที่ 1 (T1DM)
เกิดจาก ระบบภูมิคุ้มกันทำลายเซลล์ β ของตับอ่อน ซึ่งเป็นเซลล์ที่ผลิตอินซูลิน ทำให้ร่างกาย ขาดอินซูลินโดยสิ้นเชิง และไม่สามารถควบคุมระดับน้ำตาลในเลือดได้
ผู้ป่วยต้อง ฉีดอินซูลินจากภายนอก (exogenous insulin) เพื่อควบคุมระดับน้ำตาล
🧬 เบาหวานชนิดที่ 2 (T2DM)
พบได้บ่อยกว่ามาก และมักเริ่มในวัยผู้ใหญ่ เกิดจาก:
ภาวะดื้อต่ออินซูลิน (insulin resistance)
การหลั่งอินซูลินที่ผิดปกติจากเซลล์ β ของตับอ่อน
ผลกระทบของเบาหวานต่อร่างกายและการสมานกระดูก
หาก ไม่สามารถควบคุมระดับน้ำตาลในเลือดได้อย่างต่อเนื่อง จะนำไปสู่การสะสมของผลิตภัณฑ์ AGE (Advanced Glycation End-products) ในเนื้อเยื่อต่าง ๆ ของร่างกาย โดยเฉพาะใน สารระหว่างเซลล์ (extracellular matrix)
การสะสมของ AGE เหล่านี้จะ:
เปลี่ยนแปลงการทำงานของเซลล์เยื่อบุหลอดเลือด (endothelial cells)
ส่งผลต่อเซลล์กล้ามเนื้อเรียบ (smooth muscle cells)
รบกวนหน้าที่ของแมคโครฟาจ (macrophages)
ทำให้เกิดกระบวนการ microangiopathy และ macroangiopathy ซึ่งเป็นที่มาของภาวะแทรกซ้อนต่าง ๆ เช่น:
โรคปลายประสาทเสื่อม (Peripheral neuropathy)
โรคไตจากเบาหวาน (Nephropathy)
จอประสาทตาเสื่อม (Retinopathy)
โรคข้อจากเบาหวาน (Arthropathy)
ผลต่อการหายของกระดูกหัก
การไหลเวียนเลือดที่ลดลง (ischemia) ร่วมกับการทำงานของเซลล์ที่ผิดปกติในผู้ป่วยเบาหวาน
➡️ ส่งผลให้ การตอบสนองต่อการบาดเจ็บของกระดูกลดลง
➡️ และ ชะลอการสมานของกระดูก อย่างมีนัยสำคัญ
เบาหวานและผลกระทบต่อการสมานกระดูก รวมถึงบทบาทของ LIPUS
1. 📉 การสมานกระดูกในผู้ป่วยเบาหวาน: หลักฐานจากมนุษย์
งานวิจัยทางคลินิกในมนุษย์เกี่ยวกับการสมานกระดูกในผู้ป่วยเบาหวานมีอยู่อย่างจำกัด
ตั้งแต่ปี 1972 มีรายงานว่า การเกิดคอลลัส (callus) และการแคลซิไฟด์ของกระดูกในผู้ป่วยเบาหวานล่าช้ากว่าปกติ
Loder et al. วิเคราะห์ย้อนหลังจากผู้ป่วยเบาหวาน 28 คนที่มีการหักกระดูกแบบปิด และพบว่า
📌 ระยะเวลาการสมานกระดูก นานกว่าค่าที่ควรจะเป็นประมาณ 1.63 เท่า
📌 ไม่พบความแตกต่างระหว่างเบาหวานชนิดที่ 1 และ 2
2. 🦴 ความผิดปกติของกระดูกในผู้ป่วยเบาหวาน
การทำความเข้าใจโครงสร้างกระดูกในภาวะปกติจำเป็นต้องใช้เทคนิค DXA (Dual X-ray Absorptiometry)
ซึ่งแม่นยำ ปลอดภัย ใช้เวลาน้อย และได้รับรังสีต่ำ
🔬 ความแตกต่างในมวลกระดูก (BMD):
เบาหวานชนิดที่ 1: มวลกระดูกลดลง ความเสี่ยงกระดูกหักสูงขึ้น
➡️ เนื่องจากขาดอินซูลิน ➡️ เซลล์สร้างกระดูก (osteoblasts) ทำงานลดลง ➡️ กระดูกพรุน, โครงสร้างไม่สมบูรณ์เบาหวานชนิดที่ 2: มวลกระดูกสูงขึ้นแต่คุณภาพแย่ลง
➡️ ความผิดปกติของฮอร์โมนและกลไกอื่น ๆ ส่งผลให้กระดูกเปราะง่าย
3. 🐁 หลักฐานจากสัตว์ทดลอง
🐀 เบาหวานจากการเหนี่ยวนำในหนู ส่งผลให้:
การสร้างกระดูกแบบ intramembranous ossification บกพร่อง
คอลลัสบางลง เซลล์น้อยลง หลอดเลือดใหม่ลดลง
กระดูกใหม่ไม่แข็งแรง ความแข็งแรงเชิงกลลดลง
การทดลองแบบ distraction osteogenesis แสดงให้เห็นว่า:
กลุ่มเบาหวานมีกระดูกเชื่อมต่อกันเพียง 19.3% เทียบกับ 52.4% ในกลุ่มปกติ
🧪 Glycemic control สำคัญมาก:
รักษาหนูเบาหวานด้วยอินซูลินทำให้:เซลล์ต้นกำเนิด, cartilage และ bone content กลับมาใกล้เคียงปกติ
การฟื้นตัวดีขึ้นทั้งในระยะต้นและปลายของการสมานกระดูก
4. 🧬 กลไกระดับโมเลกุลที่เบาหวานส่งผลต่อการสมานกระดูก
เพิ่มการทำลายกระดูกผ่านการกระตุ้น osteoclasts และเพิ่ม apoptosis ของ chondrocytes
การแสดงออกของ TNF-α และ chemokines เพิ่มขึ้น ทำให้กระดูกอ่อนถูกทำลายเร็ว
ลดระดับ PDGF, ลดการแบ่งเซลล์
ลดการแสดงออกของยีนที่ควบคุมการเจริญของ osteoblasts
BMPs ต่างกันระหว่างกระดูกแบบ intramembranous และ endochondral — จำเป็นต่อ homeostasis
5. 💉 วิธีเสริม (Adjuncts) เพื่อช่วยการสมานกระดูกในเบาหวาน
อินซูลิน (ทั้งระบบและเฉพาะที่):
ช่วยฟื้นฟูการสมานกระดูก
เพิ่มความแข็งแรงเชิงกลของกระดูก
แม้ไม่เปลี่ยนระดับน้ำตาลในเลือดโดยตรง แต่ช่วยเฉพาะจุดได้
PRP (Platelet-Rich Plasma):
เพิ่ม growth factors เช่น PDGF, TGF, IGF
ปรับปรุงคุณภาพคอลลัส และการสมานกระดูกทั้งระยะต้น–ปลาย
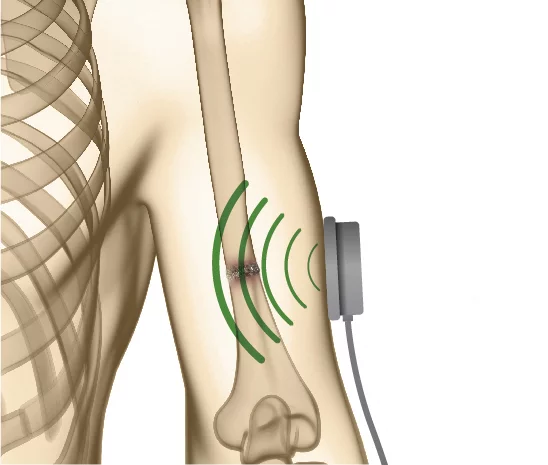
คลื่นเสียงความถี่ต่ำแบบพัลส์ (Low Intensity Pulsed Ultrasound – LIPUS)
คลื่นเสียงความถี่สูง (Ultrasound) คือ คลื่นแรงดันที่แพร่กระจายผ่านเนื้อเยื่อเพื่อส่งพลังงานเชิงกล เข้าสู่ร่างกาย โดยมีการนำไปใช้ทั้งในการ วินิจฉัย (imaging) และ รักษา (therapeutic) เช่น การตรวจวินิจฉัยด้วยภาพ หรือแม้แต่การรักษามะเร็งบางชนิด
ในการบำบัดด้วย LIPUS:
ความเข้มของคลื่นเสียงถูกตั้งไว้ที่ 30 mW/cm²
ความถี่ 1.5 MHz
พัลส์นาน 200 ไมโครวินาที (μs)
คลื่นถูกส่งผ่าน หัวตรวจอัลตราซาวนด์ ที่วางบนผิวหนังเหนือบริเวณกระดูกหัก โดยใช้ เจลชนิดน้ำเป็นตัวนำ
การรักษามาตรฐานคือ วันละ 20 นาที ต่อเนื่องตามระยะเวลาการรักษาที่กำหนด
🦴 กลไกการทำงานของ LIPUS กับกระดูก
หัวส่งคลื่นเสียง (transducer) ที่มีผลึก piezoelectric จะปล่อย คลื่นแรงดันตามยาว (longitudinal pressure waves)
คลื่นเหล่านี้เดินทางผ่านเนื้อเยื่ออ่อนจนถึงกระดูก
เมื่อชนกับกระดูก คลื่นจะเกิดการเปลี่ยนรูปแบบ (mode conversion) กลายเป็น คลื่นเฉือน (shear waves) ที่ทำให้เกิด การเคลื่อนไหวระดับอนุภาค
การเคลื่อนไหวนี้เกิดในระดับที่เล็กมาก:
บางการศึกษาแสดงว่าการสั่นสะเทือนมีขนาดประมาณ 0.55 นาโนเมตร (nm)
ในบางการศึกษาระบุว่าอาจเกิดการ เคลื่อนไหวสูงถึง 2 มิลลิเมตร (mm) โดยเฉพาะในบริเวณรอยต่อระหว่าง คอลลัสอ่อนและแข็ง (soft and hard callus)
🧬 ผลกระทบต่อการสมานกระดูก
การเคลื่อนไหวระดับจุลภาคนี้ (micromotion) ช่วยกระตุ้น:
กระบวนการส่งสัญญาณภายในเซลล์ (cellular signaling)
การเปลี่ยนแปลงของเซลล์ต้นกำเนิดให้กลายเป็นเซลล์สร้างกระดูก (osteogenic differentiation)
ซึ่งเป็นกระบวนการสำคัญที่พบใน การสมานกระดูกตามธรรมชาติ
ผลกระทบจาก LIPUS นี้ คล้ายกับกลไกที่กระดูกตอบสนองต่อแรงกดดันทางกล (mechanical stress) ตามทฤษฎีของ กฎของวูล์ฟ (Wolff’s law)

คลื่นเสียงความถี่ต่ำแบบพัลส์ (Low Intensity Pulsed Ultrasound – LIPUS)
คลื่นเสียงความถี่สูง (Ultrasound) คือ คลื่นแรงดันที่แพร่กระจายผ่านเนื้อเยื่อเพื่อส่งพลังงานเชิงกล เข้าสู่ร่างกาย โดยมีการนำไปใช้ทั้งในการ วินิจฉัย (imaging) และ รักษา (therapeutic) เช่น การตรวจวินิจฉัยด้วยภาพ หรือแม้แต่การรักษามะเร็งบางชนิด
ในการบำบัดด้วย LIPUS:
ความเข้มของคลื่นเสียงถูกตั้งไว้ที่ 30 mW/cm²
ความถี่ 1.5 MHz
พัลส์นาน 200 ไมโครวินาที (μs)
คลื่นถูกส่งผ่าน หัวตรวจอัลตราซาวนด์ ที่วางบนผิวหนังเหนือบริเวณกระดูกหัก โดยใช้ เจลชนิดน้ำเป็นตัวนำ
การรักษามาตรฐานคือ วันละ 20 นาที ต่อเนื่องตามระยะเวลาการรักษาที่กำหนด
🦴 กลไกการทำงานของ LIPUS กับกระดูก
หัวส่งคลื่นเสียง (transducer) ที่มีผลึก piezoelectric จะปล่อย คลื่นแรงดันตามยาว (longitudinal pressure waves)
คลื่นเหล่านี้เดินทางผ่านเนื้อเยื่ออ่อนจนถึงกระดูก
เมื่อชนกับกระดูก คลื่นจะเกิดการเปลี่ยนรูปแบบ (mode conversion) กลายเป็น คลื่นเฉือน (shear waves) ที่ทำให้เกิด การเคลื่อนไหวระดับอนุภาค
การเคลื่อนไหวนี้เกิดในระดับที่เล็กมาก:
บางการศึกษาแสดงว่าการสั่นสะเทือนมีขนาดประมาณ 0.55 นาโนเมตร (nm)
ในบางการศึกษาระบุว่าอาจเกิดการ เคลื่อนไหวสูงถึง 2 มิลลิเมตร (mm) โดยเฉพาะในบริเวณรอยต่อระหว่าง คอลลัสอ่อนและแข็ง (soft and hard callus)
🧬 ผลกระทบต่อการสมานกระดูก
การเคลื่อนไหวระดับจุลภาคนี้ (micromotion) ช่วยกระตุ้น:
กระบวนการส่งสัญญาณภายในเซลล์ (cellular signaling)
การเปลี่ยนแปลงของเซลล์ต้นกำเนิดให้กลายเป็นเซลล์สร้างกระดูก (osteogenic differentiation)
ซึ่งเป็นกระบวนการสำคัญที่พบใน การสมานกระดูกตามธรรมชาติ
ผลกระทบจาก LIPUS นี้ คล้ายกับกลไกที่กระดูกตอบสนองต่อแรงกดดันทางกล (mechanical stress) ตามทฤษฎีของ กฎของวูล์ฟ (Wolff’s law)
งานวิจัยแสดงให้เห็นว่า LIPUS สามารถ กระตุ้นกระบวนการ enchondral ossification ส่งผลให้:
การสร้าง คอลลัสกระดูก (bony callus) เพิ่มขึ้น
มีการสะสมแร่ธาตุมากขึ้นในกระดูก
เพิ่ม มวลของกระดูกคอร์ติคอล (cortical bone mass)
ซึ่งทั้งหมดนี้นำไปสู่ การสร้างคอลลัสที่เร็วขึ้น และ ช่องว่างระหว่างปลายกระดูก (fracture gap) เล็กลง
🔬 กลไกที่เป็นไปได้: การกระตุ้นการเปลี่ยนแปลงเซลล์
การเพิ่มความแข็งแรงของคอลลัสที่เห็นได้นั้น อาจเกิดจาก LIPUS กระตุ้นการเปลี่ยนแปลง (differentiation) ของเซลล์ที่เกี่ยวข้องกับการสมานกระดูก ได้แก่:
เซลล์สร้างกระดูก (osteoblasts)
เซลล์สร้างกระดูกอ่อน (chondroblasts)
เซลล์ต้นกำเนิดมีเซนไคม์ (mesenchymal stem cells)
ไฟโบรบลาสต์ (fibroblasts)
มีงานวิจัยยืนยันว่า LIPUS สามารถกระตุ้นการแสดงออกของ aggrecan ซึ่งเป็น โปรตีนสำคัญของเมทริกซ์ในกระดูกอ่อน
➡️ Aggrecan นี้ช่วยเร่งให้ chondroblasts เปลี่ยนเป็น chondrocytes ซึ่งมีบทบาทสำคัญในการสร้าง chondroitin
➡️ Chondroitin คือ แมโครโมเลกุลโครงสร้างหลักของกระดูกอ่อน
🧬 บทบาทของไขกระดูก (Bone Marrow) และการกระตุ้นยีน
ไขกระดูก เป็นแหล่งสำคัญของเซลล์ต้นกำเนิดที่ยังไม่เปลี่ยนแปลง ซึ่งสามารถพัฒนาไปเป็นทั้ง:
เซลล์สร้างกระดูกอ่อน (chondrocytes)
เซลล์สร้างกระดูก (osteoblasts)
การกระตุ้นด้วย LIPUS ไปยังบริเวณที่หัก จะนำไปสู่การ:
กระตุ้น integrin บนพื้นผิวเซลล์
เพิ่ม การแสดงออกของยีน ที่เกี่ยวข้องกับการสร้างกระดูก เช่น:
osteonectin
osteopontin
insulin-like growth factor-1 (IGF-1)
สิ่งนี้แสดงให้เห็นกลไกหนึ่งที่ LIPUS อาจใช้กระตุ้น เซลล์ต้นกำเนิด mesenchymal ให้เปลี่ยนเป็น osteoblasts ได้เร็วขึ้น
➡️ ส่งผลต่อการ ซ่อมแซมกระดูก และ การปรับโครงสร้างกระดูก (remodeling) ให้ดีขึ้น
🩻 การตอบสนองของเยื่อหุ้มกระดูก (Periosteum) ต่อ LIPUS
Leung et al. รายงานว่า LIPUS กระตุ้นให้เยื่อหุ้มกระดูก (periosteal tissue) มีการ:
เพิ่มการแสดงออกของ osteocalcin, alkaline phosphatase และ VEGF (Vascular Endothelial Growth Factor)
ส่งผลให้เกิด:
การสะสมแร่ธาตุในเนื้อกระดูก (แสดงผลด้วยการย้อมสี alizarin red)
การสร้างหลอดเลือดใหม่ (angiogenesis)
ข้อจำกัดในปัจจุบันและแนวทางการศึกษาต่อไปเกี่ยวกับ LIPUS
ความไม่เป็นเอกภาพของหลักฐานวิจัยที่มีอยู่ในปัจจุบัน ทำให้ ยังไม่สามารถรองรับการใช้ LIPUS เป็นแนวทางการรักษามาตรฐานได้อย่างชัดเจน อย่างไรก็ตาม จำเป็นต้องมีการศึกษาวิจัยเพิ่มเติม โดยมุ่งเน้นไปที่การ จำแนกกลุ่มผู้ป่วยย่อย ที่อาจได้รับประโยชน์จากการรักษาด้วย LIPUS มากที่สุด
หนึ่งในกลุ่มที่มีศักยภาพสูงในการตอบสนองต่อ LIPUS คือ ผู้ป่วยเบาหวาน
ซึ่งมักประสบปัญหาการสมานกระดูกล่าช้า (delayed union) หรือไม่สมานเลย (non-union) อันมีสาเหตุมาจาก ปัจจัยระดับโมเลกุล เซลล์ และชีววิทยาหลายประการ
จากการศึกษาสัตว์ทดลอง พบว่า LIPUS อาจช่วยย้อนกลับกลไกที่เป็นสาเหตุของการไม่สมานของกระดูกในผู้ป่วยเบาหวานได้
แต่ขณะนี้ ยังไม่มีงานวิจัยในมนุษย์ ที่สามารถยืนยันผลดังกล่าวได้อย่างชัดเจน
ในบริบทที่จำนวนผู้ป่วยเบาหวานมีแนวโน้มเพิ่มขึ้นอย่างต่อเนื่อง
และอัตราภาวะแทรกซ้อนด้านการสมานกระดูกยังคงสูง
จึงเป็นเรื่องเร่งด่วนที่ควรมีการศึกษาเพิ่มเติม เพื่อ ค้นหาศักยภาพที่แท้จริงของ LIPUS ในการรักษาภาวะกระดูกหักในผู้ป่วยเบาหวาน
REFERENCES
- 1.Gandhi A., Liporace F., Azad V., Mattie J., Lin S. Diabetic fracture healing. Foot Ankle Clin. 2006;11(4):805–824. doi: 10.1016/j.fcl.2006.06.009. [DOI] [PubMed] [Google Scholar]
- 2.Wukich D.K., Joseph A., Ryan M., Ramirez C., Irrgang J.J. Outcomes of ankle fractures in patients with uncomplicated versus complicated diabetes. Foot Ankle Int. 2011;32(2):120–130. doi: 10.3113/FAI.2011.0120. PubMed PMID: 21288410. [DOI] [PubMed] [Google Scholar]
- 3.Wukich D.K., Kline A.J. The management of ankle fractures in patients with diabetes. J Bone Jt Surg Am Vol. 2008;90(7):1570–1578. doi: 10.2106/JBJS.G.01673. PubMed PMID: 18594108. [DOI] [PubMed] [Google Scholar]
- 4.Kristiansen T.K., Ryaby J.P., McCabe J., Frey J.J., Roe L.R. Accelerated healing of distal radial fractures with the use of specific, low-intensity ultrasound. A multicenter, prospective, randomized, double-blind, placebo-controlled study. J Bone Jt Surg Am Vol. 1997;79(7):961–973. doi: 10.2106/00004623-199707000-00002. PubMed PMID: 9234872. [DOI] [PubMed] [Google Scholar]
- 5.Low-intensity pulsed ultrasound to promote healing of fresh fractures at high risk of non-healing. 2020. https://www.nice.org.uk/guidance/IPG622 Nice.org.uk.
- 6.Poolman R., Agoritsas T., Siemieniuk R. Low intensity pulsed ultrasound (LIPUS) for bone healing: a clinical practice guideline. BMJ. 2017:j576. doi: 10.1136/bmj.j576. [DOI] [PubMed] [Google Scholar]
- 7.Aaron R.K., Ciombor D.M., Simon B.J. Treatment of nonunions with electric and electromagnetic fields. Clin Orthop Relat Res. 2004;(419):21–29. doi: 10.1097/00003086-200402000-00005. PubMed PMID: 15021127. [DOI] [PubMed] [Google Scholar]
- 8.Shibuya N., Humphers J.M., Fluhman B.L., Jupiter D.C. Factors associated with nonunion, delayed union, and malunion in foot and ankle surgery in diabetic patients. J Foot Ankle Surg: official publication of the American College of Foot and Ankle Surgeons. 2013;52(2):207–211. doi: 10.1053/j.jfas.2012.11.012. PubMed PMID: 23313498. [DOI] [PubMed] [Google Scholar]
- 9.Tsiridis E., Upadhyay N., Giannoudis P. Molecular aspects of fracture healing: which are the important molecules? Injury. 2007;38(Suppl 1):S11–S25. doi: 10.1016/j.injury.2007.02.006. PubMed PMID: 17383481. [DOI] [PubMed] [Google Scholar]
- 10.Phillips A.M. Overview of the fracture healing cascade. Injury. 2005;36(Suppl 3):S5–S7. doi: 10.1016/j.injury.2005.07.027. PubMed PMID: 16188551. [DOI] [PubMed] [Google Scholar]
- 11.Mehta S.K., Breitbart E.A., Berberian W.S., Liporace F.A., Lin S.S. Bone and wound healing in the diabetic patient. Foot Ankle Clin. 2010;15(3):411–437. doi: 10.1016/j.fcl.2010.03.005. PubMed PMID: 20682414. [DOI] [PubMed] [Google Scholar]
- 12.Facts and Stats. Diabetes UK. 2016. https://diabetes-resources-production.s3-eu-west-1.amazonaws.com/diabetes-storage/migration/pdf/DiabetesUK_Facts_Stats_Oct16.pdf [Google Scholar]
- 13.Cozen L. Does diabetes delay fracture healing? Clin Orthop Relat Res. 1972;82:134–140. PubMed PMID: 5011018. [PubMed] [Google Scholar]
- 14.Loder R.T. The influence of diabetes mellitus on the healing of closed fractures. Clin Orthop Relat Res. 1988;(232):210–216. PubMed PMID: 3289812. [PubMed] [Google Scholar]
- 15.Blake G.M., Fogelman I. The role of DXA bone density scans in the diagnosis and treatment of osteoporosis. Postgrad Med. 2007;83(982):509–517. doi: 10.1136/pgmj.2007.057505. PubMed PMID: 17675543; PubMed Central PMCID: PMCPMC2600106. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Garg M.K., Kharb S. Dual energy X-ray absorptiometry: pitfalls in measurement and interpretation of bone mineral density. Indian J Endocrinol Metab. 2013;17(2):203–210. doi: 10.4103/2230-8210.109659. PubMed PMID: 23776890; PubMed Central PMCID: PMCPMC3683192. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Vestergaard P. Discrepancies in bone mineral density and fracture risk in patients with type 1 and type 2 diabetes–a meta-analysis. Osteoporos Int. 2007;18(4):427–444. doi: 10.1007/s00198-006-0253-4. PubMed PMID: 17068657. [DOI] [PubMed] [Google Scholar]
- 18.McCabe L.R. Understanding the pathology and mechanisms of type I diabetic bone loss. J Cell Biochem. 2007;102(6):1343–1357. doi: 10.1002/jcb.21573. PubMed PMID: 17975793. [DOI] [PubMed] [Google Scholar]
- 19.Kemink S.A., Hermus A.R., Swinkels L.M., Lutterman J.A., Smals A.G. Osteopenia in insulin-dependent diabetes mellitus; prevalence and aspects of pathophysiology. J Endocrinol Invest. 2000;23(5):295–303. doi: 10.1007/BF03343726. PubMed PMID: 10882147. [DOI] [PubMed] [Google Scholar]
- 20.Krakauer J.C., McKenna M.J., Buderer N.F., Rao D.S., Whitehouse F.W., Parfitt A.M. Bone loss and bone turnover in diabetes. Diabetes. 1995;44(7):775–782. doi: 10.2337/diab.44.7.775. PubMed PMID: 7789645. [DOI] [PubMed] [Google Scholar]
- 21.Suzuki K., Miyakoshi N., Tsuchida T., Kasukawa Y., Sato K., Itoi E. Effects of combined treatment of insulin and human parathyroid hormone(1-34) on cancellous bone mass and structure in streptozotocin-induced diabetic rats. Bone. 2003;33(1):108–114. doi: 10.1016/s8756-3282(03)00169-8. PubMed PMID: 12919705. [DOI] [PubMed] [Google Scholar]
- 22.Santana R.B., Xu L., Chase H.B., Amar S., Graves D.T., Trackman P.C. A role for advanced glycation end products in diminished bone healing in type 1 diabetes. Diabetes. 2003;52(6):1502–1510. doi: 10.2337/diabetes.52.6.1502. PubMed PMID: 12765963. [DOI] [PubMed] [Google Scholar]
- 23.Beam H.A., Parsons J.R., Lin S.S. The effects of blood glucose control upon fracture healing in the BB Wistar rat with diabetes mellitus. J Orthop Res: official publication of the Orthopaedic Research Society. 2002;20(6):1210–1216. doi: 10.1016/S0736-0266(02)00066-9. PubMed PMID: 12472231. [DOI] [PubMed] [Google Scholar]
- 24.Fowlkes J.L., Bunn R.C., Liu L. Runt-related transcription factor 2 (RUNX2) and RUNX2-related osteogenic genes are down-regulated throughout osteogenesis in type 1 diabetes mellitus. Endocrinology. 2008;149(4):1697–1704. doi: 10.1210/en.2007-1408. PubMed PMID: 18162513; PubMed Central PMCID: PMCPMC2276714. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.Macey L.R., Kana S.M., Jingushi S., Terek R.M., Borretos J., Bolander M.E. Defects of early fracture-healing in experimental diabetes. J Bone Jt Surg Am Vol. 1989;71(5):722–733. PubMed PMID: 2659600. [PubMed] [Google Scholar]
- 26.Follak N., Kloting I., Merk H. Influence of diabetic metabolic state on fracture healing in spontaneously diabetic rats. Diabetes Metab Res Rev. 2005;21(3):288–296. doi: 10.1002/dmrr.537. PubMed PMID: 15693070. [DOI] [PubMed] [Google Scholar]
- 27.Kayal R.A., Tsatsas D., Bauer M.A. Diminished bone formation during diabetic fracture healing is related to the premature resorption of cartilage associated with increased osteoclast activity. J Bone Miner Res : the official journal of the American Society for Bone and Mineral Research. 2007;22(4):560–568. doi: 10.1359/jbmr.070115. PubMed PMID: 17243865; PubMed Central PMCID: PMC3109431. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28.Kayal R.A., Alblowi J., McKenzie E. Diabetes causes the accelerated loss of cartilage during fracture repair which is reversed by insulin treatment. Bone. 2009;44(2):357–363. doi: 10.1016/j.bone.2008.10.042. PubMed PMID: 19010456; PubMed Central PMCID: PMCPMC2700945. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 29.Alblowi J., Tian C., Siqueira M.F. Chemokine expression is upregulated in chondrocytes in diabetic fracture healing. Bone. 2013;53(1):294–300. doi: 10.1016/j.bone.2012.12.006. PubMed PMID: 23262028; PubMed Central PMCID: PMCPMC3767396. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 30.Tyndall W.A., Beam H.A., Zarro C., O’Connor J.P., Lin S.S. Decreased platelet derived growth factor expression during fracture healing in diabetic animals. Clin Orthop Relat Res. 2003;(408):319–330. doi: 10.1097/00003086-200303000-00043. PubMed PMID: 12616077. [DOI] [PubMed] [Google Scholar]
- 31.Lu H., Kraut D., Gerstenfeld L.C., Graves D.T. Diabetes interferes with the bone formation by affecting the expression of transcription factors that regulate osteoblast differentiation. Endocrinology. 2003;144(1):346–352. doi: 10.1210/en.2002-220072. PubMed PMID: 12488363. [DOI] [PubMed] [Google Scholar]
- 32.Suttapreyasri S., Koontongkaew S., Phongdara A., Leggat U. Expression of bone morphogenetic proteins in normal human intramembranous and endochondral bones. Int J Oral Maxillofac Surg. 2006;35(5):444–452. doi: 10.1016/j.ijom.2006.01.021. PubMed PMID: 16513322. [DOI] [PubMed] [Google Scholar]
- 33.Macey L.R., Kana S.M., Jingushi S., Terek R.M., Borretos J., Bolander M.E. Defects of early fracture-healing in experimental diabetes. J Bone Jt Surg Am Vol. 1989;71(5):722–733. PubMed PMID: 2659600. [PubMed] [Google Scholar]
- 34.Gandhi A., Beam H.A., O’Connor J.P., Parsons J.R., Lin S.S. The effects of local insulin delivery on diabetic fracture healing. Bone. 2005;37(4):482–490. doi: 10.1016/j.bone.2005.04.039. PubMed PMID: 16027060. [DOI] [PubMed] [Google Scholar]
- 35.Gandhi A., Doumas C., O’Connor J.P., Parsons J.R., Lin S.S. The effects of local platelet rich plasma delivery on diabetic fracture healing. Bone. 2006;38(4):540–546. doi: 10.1016/j.bone.2005.10.019. PubMed PMID: 16368279. [DOI] [PubMed] [Google Scholar]
- 36.Busse J.W., Morton E., Lacchetti C., Guyatt G.H., Bhandari M. Current management of tibial shaft fractures: a survey of 450 Canadian orthopedic trauma surgeons. Acta Orthop. 2008;79(5):689–694. doi: 10.1080/17453670810016722. PubMed PMID: 18839377. [DOI] [PubMed] [Google Scholar]
- 37.Parvizi J., Vegari D. Pulsed low-intensity ultrasound for fracture healing. Foot Ankle Clin. 2005;10(4):595–608. doi: 10.1016/j.fcl.2005.06.007. vii. PubMed PMID: 16297821. [DOI] [PubMed] [Google Scholar]
- 38.Pounder N.M., Harrison A.J. Low intensity pulsed ultrasound for fracture healing: a review of the clinical evidence and the associated biological mechanism of action. Ultrasonics. 2008;48(4):330–338. doi: 10.1016/j.ultras.2008.02.005. PubMed PMID: 18486959. [DOI] [PubMed] [Google Scholar]
- 39.Claes L., Willie B. The enhancement of bone regeneration by ultrasound. Prog Biophys Mol Biol. 2007;93(1-3):384–398. doi: 10.1016/j.pbiomolbio.2006.07.021. PubMed PMID: 16934857. [DOI] [PubMed] [Google Scholar]
- 40.Parvizi J., Wu C.C., Lewallen D.G., Greenleaf J.F., Bolander M.E. Low-intensity ultrasound stimulates proteoglycan synthesis in rat chondrocytes by increasing aggrecan gene expression. J Orthop Res: official publication of the Orthopaedic Research Society. 1999;17(4):488–494. doi: 10.1002/jor.1100170405. PubMed PMID: 10459753. [DOI] [PubMed] [Google Scholar]
- 41.Sena K., Leven R.M., Mazhar K., Sumner D.R., Virdi A.S. Early gene response to low-intensity pulsed ultrasound in rat osteoblastic cells. Ultrasound Med Biol. 2005;31(5):703–708. doi: 10.1016/j.ultrasmedbio.2005.01.013. PubMed PMID: 15866420. [DOI] [PubMed] [Google Scholar]
- 42.Gurkan U.A., Akkus O. The mechanical environment of bone marrow: a review. Ann Biomed Eng. 2008;36(12):1978–1991. doi: 10.1007/s10439-008-9577-x. PubMed PMID: 18855142. [DOI] [PubMed] [Google Scholar]
- 43.Leung K.S., Cheung W.H., Zhang C., Lee K.M., Lo H.K. Low intensity pulsed ultrasound stimulates osteogenic activity of human periosteal cells. Clin Orthop Relat Res. 2004;(418):253–259. doi: 10.1097/00003086-200401000-00044. PubMed PMID: 15043127. [DOI] [PubMed] [Google Scholar]
- 44.Duarte L.R. The stimulation of bone growth by ultrasound. Archives of orthopaedic and traumatic surgery Archiv fur orthopadische und Unfall-Chirurgie. 1983;101(3):153–159. doi: 10.1007/BF00436764. PubMed PMID: 6870502. [DOI] [PubMed] [Google Scholar]
- 45.Pilla A.A., Mont M.A., Nasser P.R. Non-invasive low-intensity pulsed ultrasound accelerates bone healing in the rabbit. J Orthop Trauma. 1990;4(3):246–253. doi: 10.1097/00005131-199004030-00002. PubMed PMID: 2231120. [DOI] [PubMed] [Google Scholar]
- 46.Wang S.J., Lewallen D.G., Bolander M.E., Chao E.Y., Ilstrup D.M., Greenleaf J.F. Low intensity ultrasound treatment increases strength in a rat femoral fracture model. J Orthop Res: official publication of the Orthopaedic Research Society. 1994;12(1):40–47. doi: 10.1002/jor.1100120106. PubMed PMID: 8113941. [DOI] [PubMed] [Google Scholar]
- 47.Coords M., Breitbart E., Paglia D. The effects of low-intensity pulsed ultrasound upon diabetic fracture healing. J Orthop Res: official publication of the Orthopaedic Research Society. 2011;29(2):181–188. doi: 10.1002/jor.21223. PubMed PMID: 20886648. [DOI] [PubMed] [Google Scholar]
- 48.Gebauer G.P., Lin S.S., Beam H.A., Vieira P., Parsons J.R. Low-intensity pulsed ultrasound increases the fracture callus strength in diabetic BB Wistar rats but does not affect cellular proliferation. J Orthop Res: official publication of the Orthopaedic Research Society. 2002;20(3):587–592. doi: 10.1016/S0736-0266(01)00136-X. PubMed PMID: 12038635. [DOI] [PubMed] [Google Scholar]
- 49.Watanabe Y., Matsushita T., Bhandari M., Zdero R., Schemitsch E.H. Ultrasound for fracture healing: current evidence. J Orthop Trauma. 2010;24(Suppl 1):S56–S61. doi: 10.1097/BOT.0b013e3181d2efaf. PubMed PMID: 20182238. [DOI] [PubMed] [Google Scholar]
- 50.Heckman J.D., Ryaby J.P., McCabe J., Frey J.J., Kilcoyne R.F. Acceleration of tibial fracture-healing by non-invasive, low-intensity pulsed ultrasound. J Bone Jt Surg Am Vol. 1994;76(1):26–34. doi: 10.2106/00004623-199401000-00004. PubMed PMID: 8288661. [DOI] [PubMed] [Google Scholar]
- 51.Busse J.W., Bhandari M., Kulkarni A.V., Tunks E. The effect of low-intensity pulsed ultrasound therapy on time to fracture healing: a meta-analysis. CMAJ. 2002;166(4):437–441. PubMed PMID: 11873920; PubMed Central PMCID: PMCPMC99352. [PMC free article] [PubMed] [Google Scholar]
- 52.Busse J.W., Kaur J., Mollon B. Low intensity pulsed ultrasonography for fractures: systematic review of randomised controlled trials. BMJ. 2009;338:b351. doi: 10.1136/bmj.b351. PubMed PMID: 19251751; PubMed Central PMCID: PMCPMC2651102. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 53.Watanabe Y., Matsushita T., Bhandari M., Zdero R., Schemitsch E.H. Ultrasound for fracture healing: current evidence. J Orthop Trauma. 2010;24(Suppl 1):S56–S61. doi: 10.1097/BOT.0b013e3181d2efaf. PubMed PMID: 20182238. [DOI] [PubMed] [Google Scholar]
- 54.Mundi R., Petis S., Kaloty R., Shetty V., Bhandari M. Low-intensity pulsed ultrasound: fracture healing. Indian J Orthop. 2009;43(2):132–140. doi: 10.4103/0019-5413.50847. PubMed PMID: 19838361; PubMed Central PMCID: PMCPMC2762261. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 55.Schandelmaier S., Kaushal A., Lytvyn L. Low intensity pulsed ultrasound for bone healing: systematic review of randomized controlled trials. BMJ. 2017;356:j656. doi: 10.1136/bmj.j656. PubMed PMID: 28348110; PubMed Central PMCID: PMCPMC5484179. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 56.group TIw, Busse J.W., Bhandari M. Re-evaluation of low intensity pulsed ultrasound in treatment of tibial fractures (TRUST): randomized clinical trial. BMJ. 2016;355:i5351. doi: 10.1136/bmj.i5351. PubMed PMID: 27797787; PubMed Central PMCID: PMCPMC5080447 at www.icmje.org/coi_disclosure.pdf and declare: TAE, ES, and MB have received consulting fees from Smith & Nephew, the manufacturer of the study device. PT receives royalties from Smith & Nephew. GJDR is a paid consultant for Bioventus LLC, which is 51% owned by Essex Woodlands and 49% by Smith & Nephew. MB is supported, in part, by a Canada research chair, McMaster University. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 57.Mayr E., Mockl C., Lenich A., Ecker M., Ruter A. [Is low intensity ultrasound effective in treatment of disorders of fracture healing?] Unfallchirurg. 2002;105(2):108–115. doi: 10.1007/s001130100301. PubMed PMID: 11968536. [DOI] [PubMed] [Google Scholar]
- 58.Nolte P.A., van der Krans A., Patka P., Janssen I.M., Ryaby J.P., Albers G.H. Low-intensity pulsed ultrasound in the treatment of nonunions. J Trauma. 2001;51(4):693–702. doi: 10.1097/00005373-200110000-00012. discussion -3. PubMed PMID: 11586161. [DOI] [PubMed] [Google Scholar]
- 59.Gebauer D., Mayr E., Orthner E., Ryaby J.P. Low-intensity pulsed ultrasound: effects on nonunions. Ultrasound Med Biol. 2005;31(10):1391–1402. doi: 10.1016/j.ultrasmedbio.2005.06.002. PubMed PMID: 16223643. [DOI] [PubMed] [Google Scholar]
- 60.Schofer M.D., Block J.E., Aigner J., Schmelz A. Improved healing response in delayed unions of the tibia with low-intensity pulsed ultrasound: results of a randomized sham-controlled trial. BMC Muscoskel Disord. 2010;11:229. doi: 10.1186/1471-2474-11-229. PubMed PMID: 20932272; PubMed Central PMCID: PMCPMC2958986. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 61.Zura R., Della Rocca G.J., Mehta S. Treatment of chronic (>1 year) fracture nonunion: heal rate in a cohort of 767 patients treated with low-intensity pulsed ultrasound (LIPUS) Injury. 2015;46(10):2036–2041. doi: 10.1016/j.injury.2015.05.042. PubMed PMID: 26052056. [DOI] [PubMed] [Google Scholar]
- 62.EXOGEN Ultrasound Bone Healing System for Long Bone Fractures with Non-union or Delayed Healing. 2013. https://www.nice.org.uk/guidance/mtg12/chapter/1-Recommendations Nice.org.uk. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 63.Griffin X.L., Parsons N., Costa M.L., Metcalfe D. Ultrasound and shockwave therapy for acute fractures in adults. Cochrane Database Syst Rev. 2014;6:CD008579. doi: 10.1002/14651858.CD008579.pub3. PubMed PMID: 24956457. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 64.Leighton R., Watson J.T., Giannoudis P., Papakostidis C., Harrison A., Steen R.G. Healing of fracture nonunions treated with low-intensity pulsed ultrasound (LIPUS): a systematic review and meta-analysis. Injury. 2017;48(7):1339–1347. doi: 10.1016/j.injury.2017.05.016. PubMed PMID: 28532896. [DOI] [PubMed] [Google Scholar]
- 65.Heckman J.D., Sarasohn-Kahn J. The economics of treating tibia fractures. The cost of delayed unions. Bull Hosp Jt Dis. 1997;56(1):63–72. PubMed PMID: 9063607. [PubMed] [Google Scholar]
- 66.Mehta S., Long K., DeKoven M., Smith E., Steen R.G. Low-intensity pulsed ultrasound (LIPUS) can decrease the economic burden of fracture non-union. J Med Econ. 2015;18(7):542–549. doi: 10.3111/13696998.2015.1019887. PubMed PMID: 25708448. [DOI] [PubMed] [Google Scholar]
- Berber R, Aziz S, Simkins J, Lin SS, Mangwani J. Low Intensity Pulsed Ultrasound Therapy (LIPUS): A review of evidence and potential applications in diabetics. J Clin Orthop Trauma. 2020 Jul;11(Suppl 4):S500-S505. doi: 10.1016/j.jcot.2020.03.009. Epub 2020 Apr 21. Erratum in: J Clin Orthop Trauma. 2020 Nov-Dec;11(6):1175. doi: 10.1016/j.jcot.2020.10.023. Erratum in: J Clin Orthop Trauma. 2021 Oct;21:101561. doi: 10.1016/j.jcot.2021.101561. PMID: 32774018; PMCID: PMC7394837.